Antecedentes y diseño del estudio
Retatrutida (LY3437943) es un nuevo fármaco de un solo péptido que activatres receptores simultáneamente: GIP, GLP-1 y glucagón. Para evaluar su eficacia y seguridad en personas con obesidad pero sin diabetes, se llevó a cabo un ensayo de fase 2, aleatorizado, doble ciego y controlado con placebo (NCT04881760). Un total de338 participantesLos pacientes con un IMC ≥30, o ≥27 con al menos una comorbilidad relacionada con el peso, fueron asignados aleatoriamente para recibir placebo o retatrutida (1 mg, 4 mg con dos esquemas de titulación, 8 mg con dos esquemas de titulación o 12 mg) administrado una vez por semana mediante inyección subcutánea durante 48 semanas.criterio de valoración principalfue el cambio porcentual en el peso corporal a las 24 semanas, con criterios de valoración secundarios que incluyeron el cambio de peso a las 48 semanas y umbrales de pérdida de peso categóricos (≥5%, ≥10%, ≥15%).
Resultados clave
-
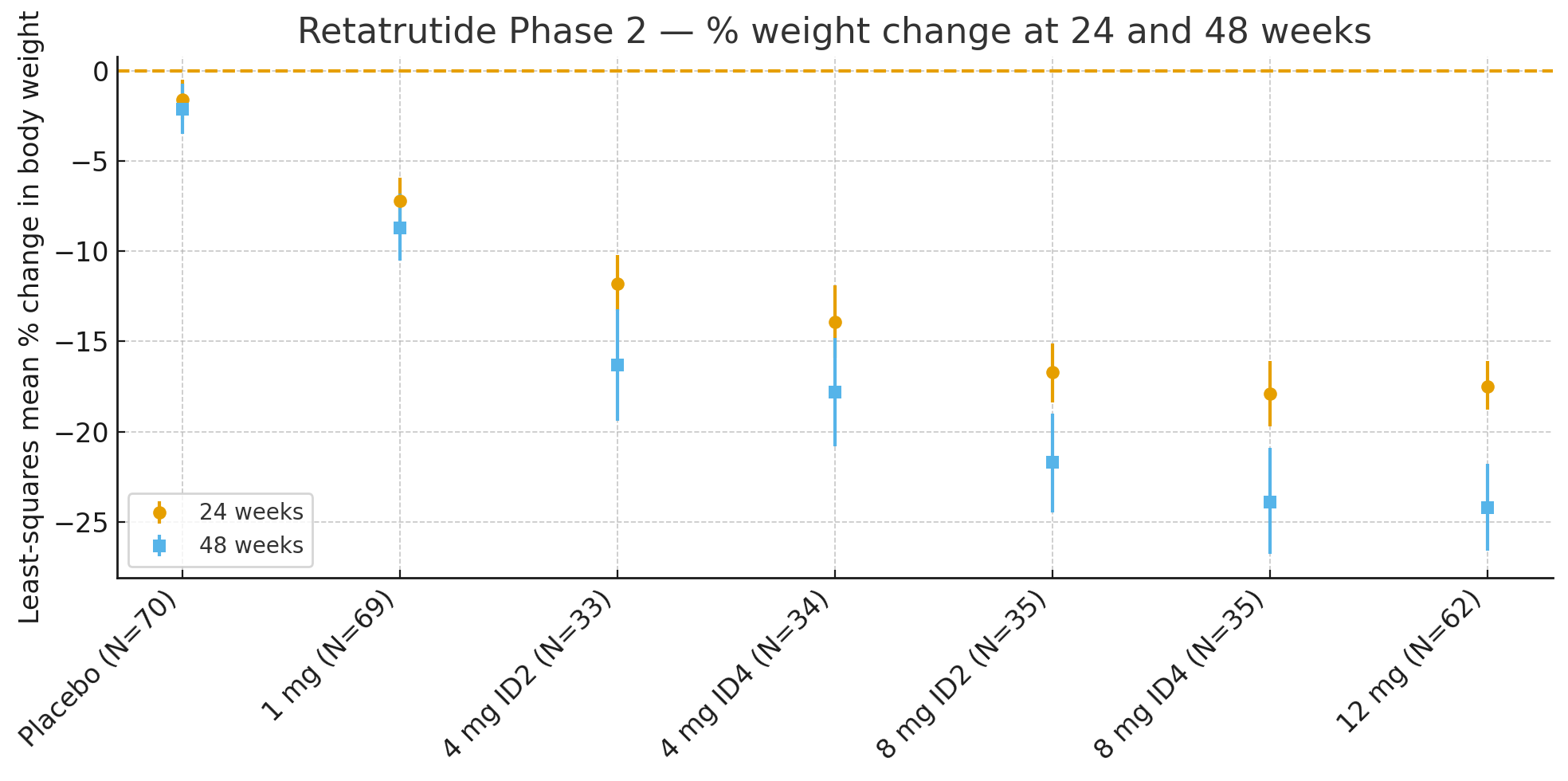
24 semanasEl cambio porcentual medio por mínimos cuadrados en el peso corporal con respecto al valor basal fue
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (combinados): −12,9 %
-
8 mg (combinados): −17,3 %
-
12 mg: −17,5%
-
-
48 semanasEl cambio porcentual en el peso corporal fue
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (combinados): −17,1%
-
8 mg (combinados): −22,8 %
-
12 mg: −24,2%
-
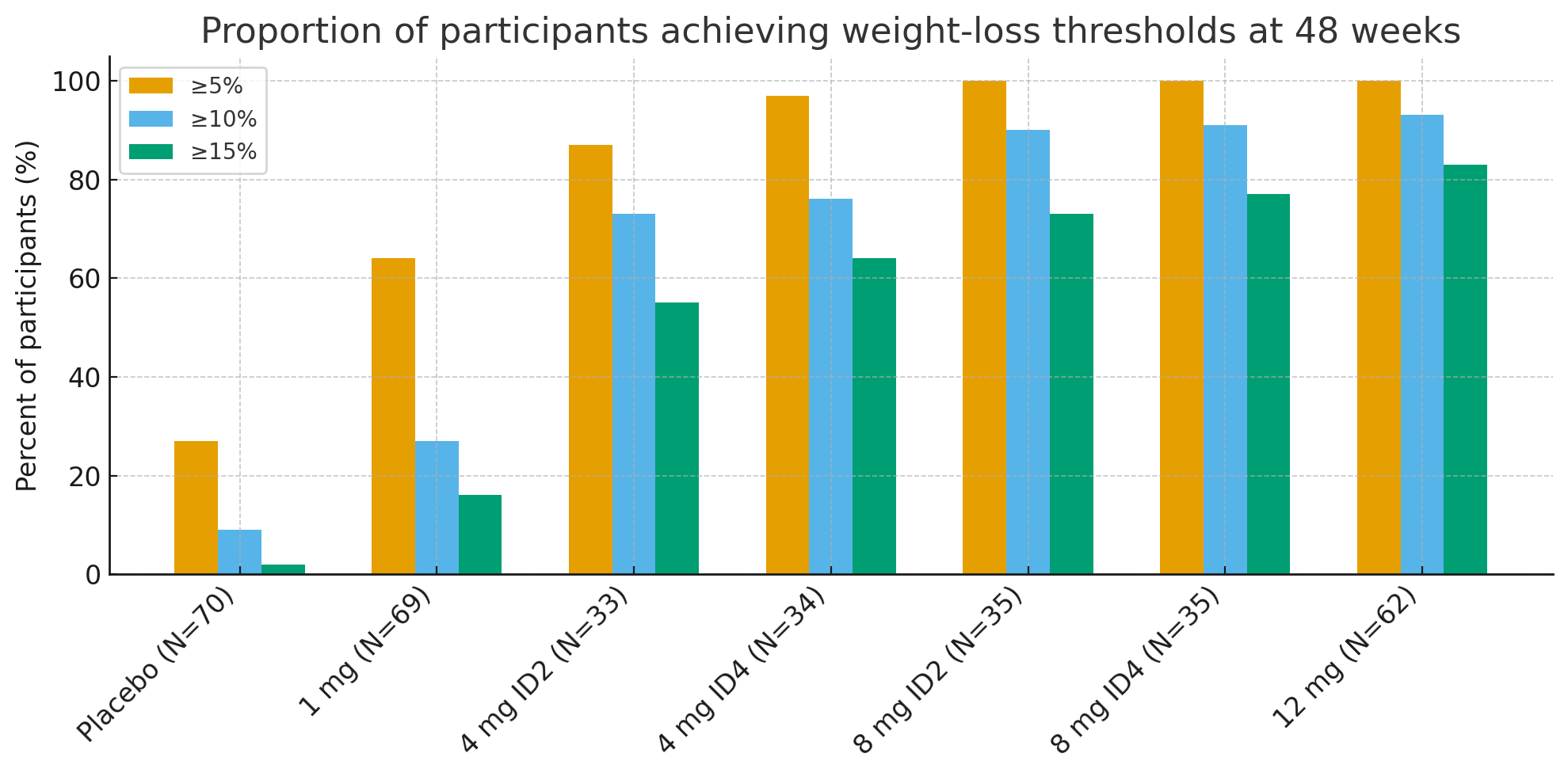
A las 48 semanas, las proporciones de participantes que alcanzaron umbrales de pérdida de peso clínicamente significativos fueron sorprendentes:
-
Pérdida de peso ≥5%: 27% con placebo frente a 92-100% en los grupos activos
-
≥10%: 9% con placebo frente a 73-93% en los grupos activos
-
≥15%: 2% con placebo frente a 55-83% en los grupos activos
En el grupo de 12 mg, hastaEl 26% de los participantes perdió ≥30% de su peso inicial., una magnitud de pérdida de peso comparable a la de la cirugía bariátrica.
Seguridad
Los eventos adversos más frecuentes fueron gastrointestinales (náuseas, vómitos, diarrea), generalmente de leves a moderados y relacionados con la dosis. Las dosis iniciales más bajas (titulación de 2 mg) redujeron estos eventos. Se observaron aumentos de la frecuencia cardíaca relacionados con la dosis, con un pico en la semana 24 y posterior descenso. Las tasas de interrupción del tratamiento oscilaron entre el 6 % y el 16 % en los grupos de tratamiento activo, algo superiores a las del placebo.
Conclusiones
En adultos con obesidad sin diabetes, la administración subcutánea semanal de retatrutida durante 48 semanas produjoreducciones sustanciales y dependientes de la dosis en el peso corporal(Hasta un 24 % de pérdida de peso media con la dosis más alta), junto con mejoras en los marcadores cardiometabólicos. Los efectos adversos gastrointestinales fueron frecuentes, pero se controlaron mediante el ajuste de la dosis. Estos resultados de la fase 2 sugieren que retatrutida podría representar un nuevo referente terapéutico para la obesidad, a la espera de confirmación en ensayos de fase 3 más amplios y a largo plazo.
Fecha de publicación: 28 de septiembre de 2025