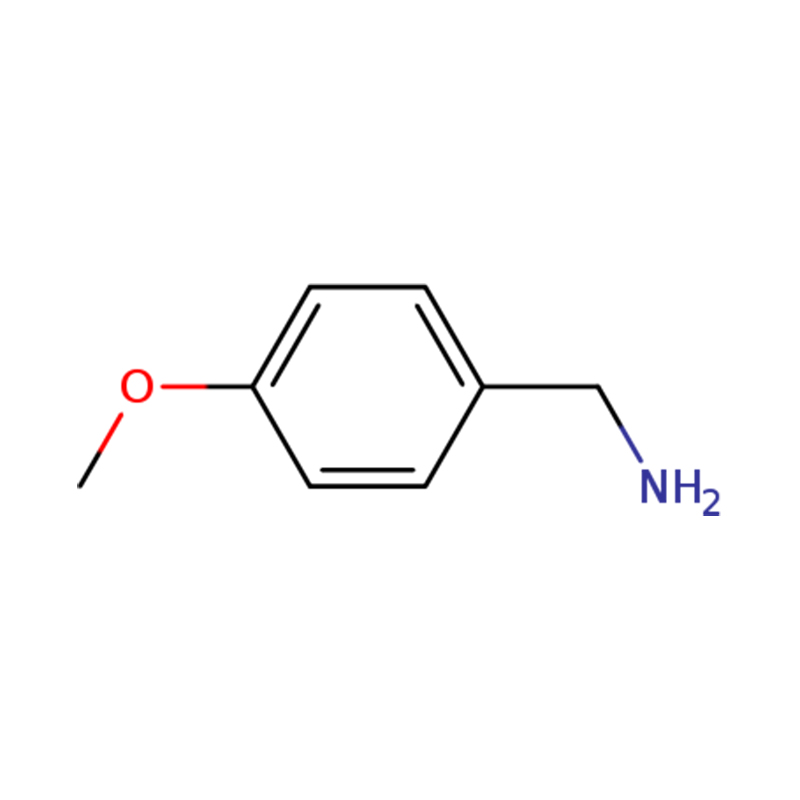
1-(4-METOXIFENIL)METANAMINA
Detalles del producto
| CasNo | 2393-23-9 | El tiempo de entrega | en un plazo de 10 días |
| Molecular | C8H11NO | Capacidad de producción | 1 tonelada métrica/día |
| Apariencia | Líquido transparente, incoloro o ligeramente amarillo | Pureza | 99% mínimo |
| Solicitud | Intermediarios farmacéuticos | Almacenamiento | Temperatura ambiente, oscuro, sellado |
| Número límite | 1 kilogramo | Transporte | Aire, mar, expreso. |
| Densidad | 1,05 g/mL a 25 °C (lit.) | Punto de ebullición | 236-237°C (lit.) |
| Punto de fusión | -10 °C | Índice de refracción | n20/D1.546(lit.) |
| Punto de inflamabilidad: | >230°F | Solubilidad | Altamente soluble en agua |
| Nombre | p-anisilamina o (4-metoxifenil)metanamina |
Sinónimos
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETIL-ANISOL; 4-METOXIBENCILAMINA; Clorhidrato de p-metoxibencilamina 173.64; 4-metoxibencilamina, 98+%; para esparfloxacina; CLORHIDRATO DE P-METOXIBENCILAMINA
Solicitud
Puede utilizarse para la síntesis de intermediarios farmacéuticos. Es ligeramente nocivo para el agua. No permita que el producto, sin diluir o en grandes cantidades, entre en contacto con aguas subterráneas, cursos de agua o sistemas de alcantarillado. Sin autorización gubernamental, no vierta el material al medio ambiente circundante para evitar el contacto con óxidos, ácidos, aire y dióxido de carbono. Mantenga el envase sellado, colóquelo en un recipiente hermético y almacénelo en un lugar fresco y seco.
Laboratorio de control de calidad
En las instalaciones se encuentra un laboratorio de control de calidad independiente donde se realizan pruebas químicas, físicas, microbiológicas, estudios de estabilidad y análisis instrumentales (IR, UV, HPLC, GC) tanto a materias primas como a productos terminados. El acceso a toda el área está controlado y se mantiene en óptimas condiciones, con el instrumental analítico suficiente para las pruebas previstas. Todos los instrumentos están debidamente etiquetados y calibrados.
QA
El departamento de Control de Calidad (QA) es responsable de evaluar y clasificar las desviaciones en mayores, menores y generales. Para todos los niveles de desviación, es necesario investigar la causa raíz o la causa potencial. La investigación debe completarse en un plazo de 7 días hábiles. Una vez finalizada la investigación y identificada la causa raíz, también se requiere una evaluación del impacto en el producto y un plan de acciones correctivas y preventivas (CAPA). La desviación se cierra cuando se implementa el plan CAPA. Todas las desviaciones, independientemente de su nivel, deben ser aprobadas por el Gerente de Control de Calidad. Tras su implementación, se confirma la efectividad del plan CAPA según lo previsto.